
Artículo publicado originalmente en farmacosalud.com.
Autora: Doctora Ana Gutiérrez Casbas. Médico Adjunto Servicio Medicina Digestiva. Hospital General Universitario de Alicante.
Introducción
La aprobación por parte de la EMA, en 2013, del primer fármaco biosimilar de Infliximab nativo u original(Remicade®, MSD), denominado CT-P13 y comercializado bajos los nombres Remsima®(Celltrion) e Inflectra®(Hospira), ha supuesto un desafío para la comunidad gastroenterológica dado que su eficacia clínica se demostró inicialmente en patología reumatológica. Sin embargo, su uso en práctica clínica se ha ido extendiendo de manera progresiva proporcionando información y publicaciones al respecto de modo creciente. Todo ello ha generado un cambio en la percepción de su uso por parte de los especialistas en EIIC.
Actualización de los datos de eficacia y seguridad de biosimilares en EIIC
Entre los datos más recientes publicados respecto a la efectividad de CT-P13 en EIIC destaca un estudio checo publicado este mismo año que incluyó a 104 pacientes, 79 con EC y 25 con CU, siendo las tasas de respuesta clínica en semana 22 respectivamente del 89% y 78%, con un 50% de curación mucosa (subcore endoscópico Mayo 0 ó 1) en semana 22 para pacientes con CU[1]. Por otra parte el estudio PROSIT-BIO, estudio italiano pendiente de publicación, presentado en forma de póster en el congreso de la organización Europea de Crohn y Colitis Ulcerosa (ECCO) 2016, aporta una información muy valiosa dado el elevado número de pacientes incluidos. Se incluyeron a un total de 397 pacientes, 223 con EC y 174 con CU, siendo 217 pacientes naives a antiTNF y 93 sometidos a switch desde infliximab nativo. Ciento cuarenta y cuatro de los 156 pacientes naives respondieron, así como 77 de 82 pacientes sometidos a switch[2]. Otro estudio checo (Keil y col.) incluyó a 52 pacientes (30 con EC y 22 con CU) observando respuesta parcial en semana 14 en el 50% de los pacientes con EC y en un 54% de los pacientes con CU. Las tasas de remisión en semana 14 fueron del 50% en EC y del 40% en CU[3]. Respecto a la seguridad, la información acumulada hasta el momento parece indicar que el perfil de seguridad del biosimilar no difiere sustancialmente del de infliximab original.

Inmunogenicidad
La generación de anticuerpos es una complicación frecuente en el tratamiento con fármacos antiTNF y condiciona disminución de los niveles del fármaco, pérdida de respuesta y potencial aparición de reacciones infusionales. El estudio israelí de Ben-Horin[4] demostró una inmunogenicidad similar y epítopos comunes entre CT-P13 e infliximab original. Estos datos han sido refrendados por los resultados del estudio NOR-SWITCH[5], en el que no se observó diferencia en la aparición de acs en los pacientes sometidos a switch en ninguno de los subgrupos estratificados por patologías.
Intercambiabilidad
Existen una serie de conceptos que conviene clarificar antes de aportar la evidencia existente acerca de la evolución de los pacientes con EIIC que, encontrándose estables bajo tratamiento con infliximab nativo o de referencia, son cambiados a tratamiento con el biosimilar (switch). Intercambio es la dispensación de un fármaco en lugar de su equivalente de acuerdo con el médico prescriptor. En el caso de sustitución no se cuenta con el acuerdo del prescriptor y finalmente la sustitución automática es la obligación local o nacional de sustituir un fármaco por su equivalente. En la UE, las decisiones sobre la capacidad de intercambio o sustitución de los biosimilares y productos biológicos de referencia se realizan a nivel nacional, no por EMA. En la tabla 1 se resumen los principales estudios que aportan evidencia en práctica clínica sobre la eficacia y seguridad del switch con CT-P13 en EIIC.
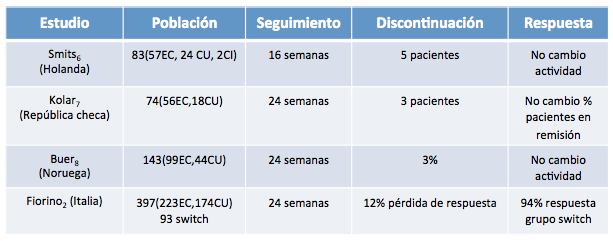
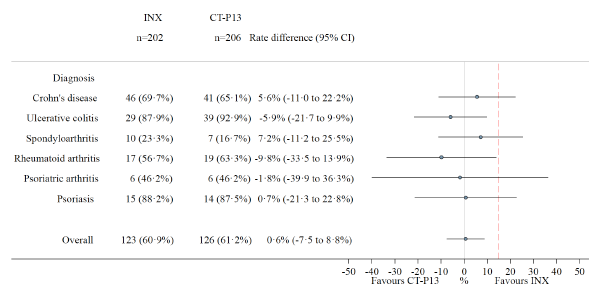
Aproximadamente 500 pacientes europeos han sido sometidos a switch con CT-P13 con una persistencia del tratamiento de entre un 57 y un 88% al final del seguimiento. En ellos no se apreció un incremento significativo de los efectos adversos o la aparición de anticuerpos. Entre los estudios que valoran los efectos del switch, uno de los principales -cuyos resultados eran esperados con elevada expectación- es el NORSWITCH[5]. Se trata de un estudio desarrollado en Noruega, esponsorizado por el propio gobierno, ramdomizado, doble ciego, de grupos paralelos de tratamiento. Tenía por objeto valorar la intercambiabilidad entre el infliximab original y Remsima® en pacientes con artritis reumatoide, espondiloartritis, artritis psoriática, CU , EC y psoriasis en placas. Fue diseñado para demostrar un margen de no inferioridad del 15%. Los cálculos estadísticos indicaron que se debían incluir 394 pacientes para valorar el objetivo primario. Se incluyeron pacientes estables de las distintas patologías durante al menos 6 meses y se randomizaron a continuar con Remicade® o a recibir tratamiento con Remsima®. Finalmente, 481 pacientes entraron en el estudio, 155 con EC y 93 con CU. Como resultado final un 26.2% de los pacientes en el brazo original vs un 29% en el CT-P13 presentaron empeoramiento clínico a lo largo del seguimiento (12 meses) (diferencia 4.4%, IC 95%:12.7-3.9). Esta ausencia de diferencia se mantuvo en las distintas patologías incluídas (Figura 1). Tampoco se observaron diferencias en inmunogenicidad ni efectos adversos entre las 2 ramas de tratamiento.
Posicionamiento de Gastroenterología respecto al uso de Biosimilares en EIIC
La ECCO[9] se posicionó inicialmente de manera cauta respecto al uso del fármaco biosimilar de Infliximab en EIIC, de igual modo que otras sociedades nacionales especializadas en EEIC. El conocimiento y experiencia en el uso del fármaco biosimilar en EIIC ha crecido de manera exponencial desde su aprobación por la EMA en 2013. Asimismo la compresión sobre el proceso de producción y aprobación del biosimilar ha influido en el cambio de percepción de los gastroenterólogos, los cuales utilizan el fármaco actualmente con mayor confianza.
En el año 2014[10] ECCO dirigió una encuesta compuesta por 15 preguntas, acerca de biosimilares en EIIC. Fue enviada a 1.000 miembros de la ECCO elegidos al azar y respondida por 307 de ellos. En ella el 89% de los participantes señalaron el ahorro económico como el factor más relevante, si bien sólo el 50% pensaba que representaban un ahorro real y un 33% opinaba que tendría un impacto marginal o incluso un sobrecoste. Por otro lado, en dicha encuesta tan sólo un 6% de los encuestados se mostraba partidario del switch. Este mismo año se han publicado los resultados de una nueva encuesta acerca de biosimilares en EIIC dirigida por ECCO[11] y respondida por 118 gastroenterólogos a través de su website. En ella se aprecia claramente la evolución positiva de la opinión y conocimiento acerca de biosimilares por los gastroenterólogos. Actualmente, un 44% de los encuestados son favorables al switch y en general la confianza y conocimiento es mayor respecto a los datos publicados hace 2 años. En ambas encuestas destaca el elevado desacuerdo de los especialistas con la sustitución automática.
Finalmente, el actual posicionamiento de ECCO[12] ha sido publicado muy recientemente. Entre sus principales conclusiones destacan:
-Un producto biosimilar registrado en la Unión Europea se considera tan eficaz como el producto de referencia
-La importancia de los registros de seguimiento a largo plazo para garantizar la seguridad de los pacientes
-El switch o intercambio es aceptable, no existiendo evidencia en switch reverso o múltiples switchs. Este debe realizarse tras adecuada discusión entre médicos, enfermeras, farmacéuticos y pacientes y de acuerdo con las recomendaciones nacionales.
Bibliografía
1. Bortlik M, Kolar M, Duricova D, et al. Biosimilar infliximab is effective and safe in inflammatory bowel disease patients naïve to anti-TNF therapy: a tertiary centre experience. Gastroenterology 2016;150:S106.
2. Fiorino G, Manetti N, Variola A, et al. Prospective observational study on inflammatory bowel disease patients treated with infliximab biosimilars: preliminary results of the PROSIT-BIO cohort of the IG-IBD. Inflamm Bowel Dis 2016; in press [poster presentation].
3. Keil R, Wasserbauer M, Zádorová Z, et al. Clinical monitoring: infliximab biosimilar CT-P13 in the treatment of Crohn’s disease and ulcerative coli- tis. Scand J Gastroenterol 2016;51:1062–8.
4. Ben-Horin S, Yavzori M, Benhar I, et al. Cross-immunogenicity: antibodies to infliximab in Remicade-treated patients with IBD similarly recognise the biosimilar Remsima. Gut 2016;65:1132–8.
5. Jørgensen K, Olsen I, Goll G, et al. Biosimilar infliximab [CT-P13] is not inferior to originator infliximab: results from the 52-week randomised NOR-SWITCH trial. 2016. Conference presentation.
6. Smits LJ, Derikx LA, de Jong DJ, et al. Clinical outcomes following a switch from Remicade® to the biosimilar CT-P13 in inflammatory bowel disease patients: a prospective observational cohort study. J Crohns Colitis 2016;10:1287–93.
7. Kolar M, Duricová D, Brotlik M, et al. Switching of patients with inflam- matory bowel disease from original infliximab [Remicade®] to biosimilar infliximab [RemsimaTM] is effective and safe. J Crohns Colitis 2016;10: S45–6.
8. Buer LCT, Moum BA, Cvarancova M, Warren DJ, Medhus AW, Hoivik ML. Switching from Remicade to Remsima is safe and feasible: a porspective, open label study. J Crohns Colitis 2016. Manuscript Doi : 10.1093/ecco-jcc/jjw166
9. Danese S, Gomollon F; Governing Board and Operational Board of ECCO. ECCO position statement: the use of biosimilar medicines in the treatment of inflammatory bowel disease [IBD]. J Crohns Colitis 2013;7:586–9.
10. Danese S, Fiorino G, Michetti P. Viewpoint: Knowledge and viewpoints on biosimilar monoclonal antibodies among members of the European Crohn’s and Colitis Organization. J Crohns Colitis. 2014. pii: S1873- 9946(14)00190-1.
11. Danese S, Fiorino G, Michetti P. Changes in biosimilar knowledge among European Crohn’s Colitis Organisation [ECCO] Members: An updated survey. J Crohns Colitis 2016;10:1362–5.
12. Danese S, Fiorino G, Raine T, Ferrante M, Kemp K, Kierkus J, Lakatos P, Mantzaris G, van der Woude J, Panes J, Peyrin-Biroulet L. ECCO Position Statement on the Use of Biosimilars for Inflammatory Bowel Disease. An Update . J Crohns Colitis 2016; 1–9 doi:10.1093/ecco-jcc/jjw198.















Comentarios
Para dejar un comentario antes debes iniciar sesión:
¿No tienes una cuenta?
Regístrate a través de éste enlace.